11月22日,信立泰发布公告称,公司自主研发的创新小分子药物SAL0119片临床试验申请获得受理,目前拟开发临床适应症包括活动性强直性脊柱炎及中重度活动性类风湿关节炎。截至目前,信立泰在今年已申报了4款1类新药。
图1:信立泰最新申报的产品情况
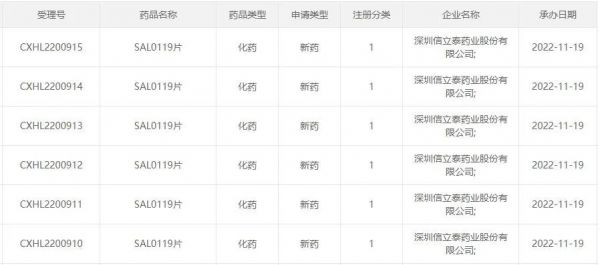
来源:CDE官网
信立泰在公告中提到,SAL0119片是一款口服小分子免疫抑制剂,目前拟开发临床适应症包括活动性强直性脊柱炎及中重度活动性类风湿关节炎。强直性脊柱炎(AS)和类风湿关节炎(RA)均属于自身免疫疾病,目前该疾病的发病原因尚不完全明确,且无法治愈。SAL0119具有独特的不同于JAK类的作用机制和广谱的细胞因子抑制作用,临床前研究数据体现出良好的有效性和安全性。
图2:国内免疫抑制剂的销售情况(单位:万元)
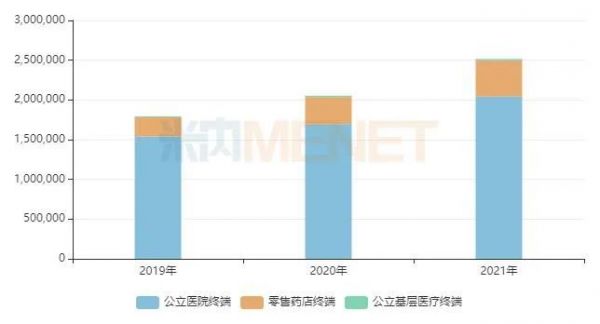
来源:米内网格局数据库
近年来,随着越来越多新品获批进入市场,免疫抑制剂的整体销售规模快速上涨,米内网数据显示,2021年在三大终端6大市场(统计范围见文末)免疫抑制剂的合计销售额已超过250亿元,公立医院终端(城市公立医院+县级公立医院)是主战场,占比达八成以上,零售药店终端(城市实体药店+网上药店)的增速较快,最近两年均保持双位数增长。
图3:今年以来信立泰申报的1类新药情况
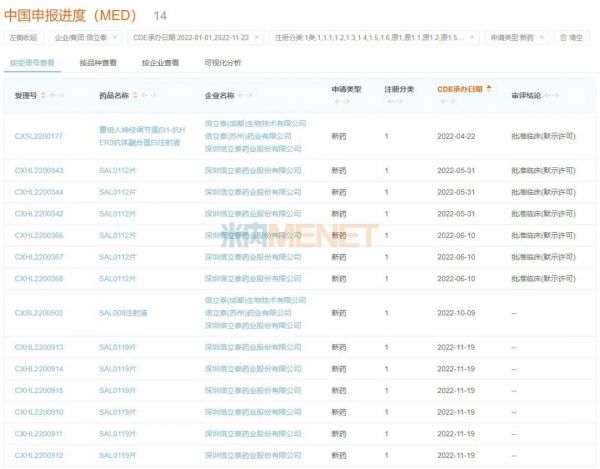 来源:米内网新版数据库
来源:米内网新版数据库
截至目前,信立泰在今年已申报了4款1类新药,其中重组人神经调节蛋白1-抗HER3抗体融合蛋白注射液和SAL0112片已获批临床。
据悉,重组人神经调节蛋白1-抗HER3抗体融合蛋白注射液是信立泰第一个中美双报的创新生物药,目前HFrEF(射血分数保留的心衰)适应症正在中美开展I期临床研究。
而SAL0112片是一款GLP-1R的口服小分子偏向激动剂,目前包括2型糖尿病、成人肥胖患者或超重患者的体重管理的适应症均已获批临床。
SAL008注射液是一款IL-15/IL-15Rα复合物与抗CTLA-4抗体的融合蛋白,拟用于晚期实体瘤的治疗,目前国内的新药临床申请正在审评审批中。该新药在欧洲提交CTA(欧洲临床试验申请)后,已启动Ⅰ期临床研究。
资料来源:CDE官网、公司公告、米内网数据库
注:米内网《中国三大终端6大市场药品竞争格局》,统计范围是:城市公立医院和县级公立医院、城市社区中心和乡镇卫生院、城市实体药店和网上药店,不含民营医院、私人诊所、村卫生室,不含县乡村药店;上述销售额以产品在终端的平均零售价计算。数据统计截至11月23日,如有疏漏,欢迎指正!